Gaceta Científica
Equivalencia terapéutica de fármacos biológicos biosimilares y de referencia en la artritis reumatoide
Los medicamentos biosimilares son versiones potencialmente más económicas de productos biológicos que pueden mejorar el acceso a la terapia.
Sin embargo, faltan revisiones sistemáticas adecuadas que demuestren la equivalencia entre estos fármacos para el tratamiento de la artritis reumatoide (AR).
OBJETIVOS: Evaluar la eficacia, seguridad e inmunogenicidad asociadas con biosimilares de adalimumab, etanercept e infliximab en comparación con sus biológicos de referencia en pacientes con AR.
FUENTES DE DATOS: Se realizaron búsquedas en MEDLINE a través de PubMed, Embase, el Registro Cochrane Central de Ensayos Controlados y las bases de datos LILACS desde el inicio hasta septiembre de 2021.
SELECCIÓN DE ESTUDIOS: Se evaluaron ensayos clínicos aleatorios (ECA) comparativos de biosimilares de adalimumab, etanercept e infliximab y sus fármacos biológicos de referencia para la AR.
EXTRACCIÓN Y SÍNTESIS DE DATOS: Dos autores resumieron todos los datos de forma independiente.
El metaanálisis se realizó con efectos aleatorios bayesianos utilizando riesgos relativos (RR) para resultados binarios y diferencias de medias estandarizadas (DME) para resultados continuos, con intervalos de credibilidad (CrI) del 95% y análisis secuencial de ensayos.
Se evaluaron dominios específicos para determinar el riesgo de sesgo en los ensayos de equivalencia y no inferioridad.
Este estudio se realizó de acuerdo con la directriz de elementos de informes preferidos para revisiones sistemáticas y metanálisis (PRISMA).
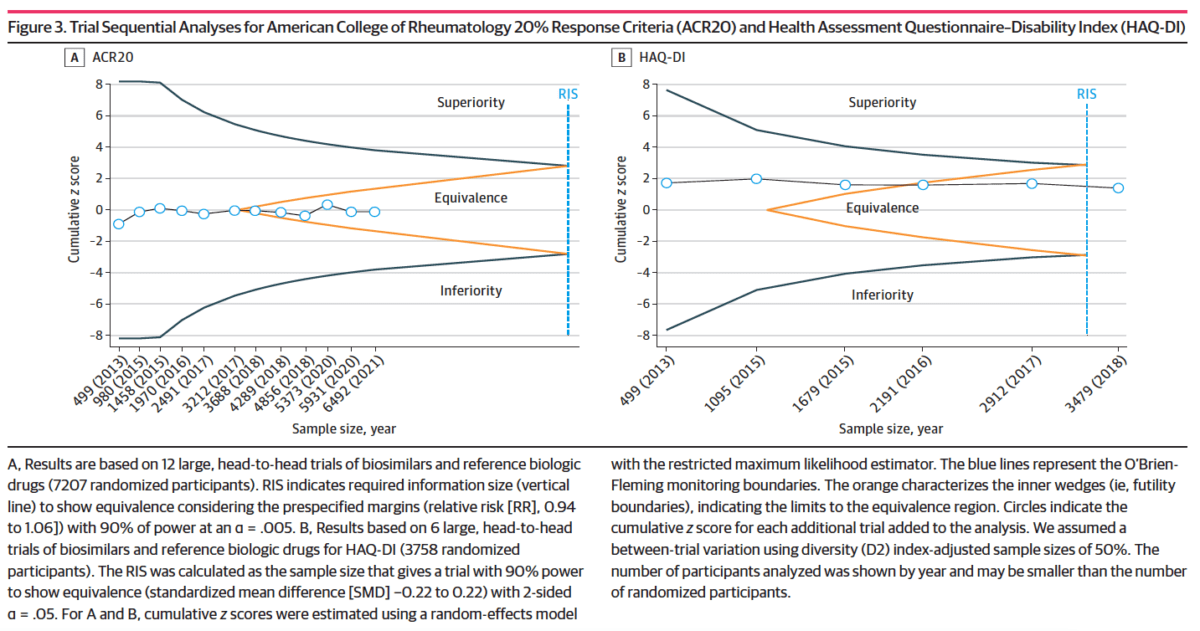
PRINCIPALES RESULTADOS Y MEDIDAS: La equivalencia se probó utilizando márgenes preespecificados para los criterios del Colegio Americano de Reumatología, con al menos un 20% de mejora en las medidas del conjunto básico (ACR20) (es decir, RR, 0,94 a 1,06), y para el Cuestionario de Evaluación de la Salud-Índice de Discapacidad (HAQ- DI) (es decir, DME, −0,22 a 0,22).
Los resultados secundarios incluyeron 14 ítems que medían la seguridad y la inmunogenicidad.
RESULTADOS: Un total de 25 ensayos comparativos proporcionaron datos sobre 10.642 pacientes aleatorizados con AR de moderada a grave.
Los biosimilares alcanzaron la equivalencia con los productos biológicos de referencia en términos de respuesta ACR20 (24 ECA con 10.259 pacientes; RR, 1,01; CrI del 95 %, 0,98 a 1,04; τ2= 0,000) y cambio de las puntuaciones HAQ-DI (14 ECA con 5579 pacientes; DME, −0,04; 95% CrI, −0,11 a 0,02; τ2= 0,002) considerando márgenes de equivalencia preespecificados.
El análisis secuencial de los ensayos encontró evidencia de equivalencia para ACR20 desde 2017 y HAQDI desde 2016.
En general, los biosimilares se asociaron con perfiles de seguridad e inmunogenicidad similares en comparación con los productos biológicos de referencia.
CONCLUSIÓN Y RELEVANCIA: En esta revisión sistemática y metanálisis, los biosimilares de adalimumab, infliximab y etanercept se asociaron con efectos de tratamiento clínicamente equivalentes en comparación con sus productos biológicos de referencia para el tratamiento de la AR.
Acceso al documento pulsando aquí.